A Food and Drug Administration, órgão de controle de alimentos e produtos médicos nos EUA, aprovou um marcapasso injetável que não usa fios que costumam causar complicações em pacientes

Com 2,5 centímetros de largura, o Micra Transacatheter Pacing System da Medtronic tem cerca de um décimo do tamanho dos marcapassos convencionais – sendo, assim, o menor do mundo na categoria.
Ele é voltado para pessoas com fibrilação atrial (um batimento cardíaco irregular ou rápido demais) e outras arritmias perigosas. A FDA aprovou o dispositivo após testes clínicos da Medtronic envolvendo 719 pacientes que tiveram o dispositivo implantado. Após seis meses, cerca de 98% dos pacientes ficaram com batimentos cardíacos adequados. Uma pequena parcela (7%) passou por algumas complicações, como doenças cardíacas, deslocamento do dispositivo e coágulos de sangue.
Marcapassos convencionais, que são cirurgicamente implantados, exigem fios que vão do marcapasso até um implante localizado logo abaixo da clavícula. Esses fios passam através da veia diretamente até o ventrículo direito do coração, levando impulsos elétricos para tratar de batimentos cardíacos irregulares ou estagnados. O problema é que esses fios nem sempre funcionam perfeitamente. Eles podem também causar problemas quando infecções se desenvolvem no tecido ao redor deles, exigindo procedimentos cirúrgicos para substituir o marcapasso.
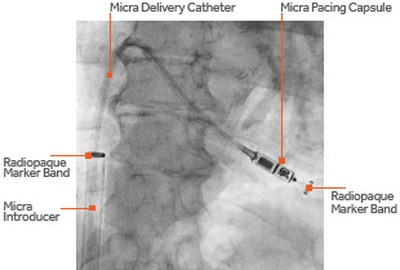 O Micra não usa fios condutores. O dispositivo se posiciona no coração com a ajuda de pequenos ganchos, levando ate lá pequenos pulsos elétricos que fazem o coração bater com mais regularidade. O dispositivo é implantado através de um tubo de 1 metro inserido em uma veia na virilha do paciente. Ele viaja pela veia até chegar ao ventrículo direito do coração. O Micra só atua na câmara inferior do coração, não podendo ser usado por quem precisa de ajuda na câmara superior.
O Micra não usa fios condutores. O dispositivo se posiciona no coração com a ajuda de pequenos ganchos, levando ate lá pequenos pulsos elétricos que fazem o coração bater com mais regularidade. O dispositivo é implantado através de um tubo de 1 metro inserido em uma veia na virilha do paciente. Ele viaja pela veia até chegar ao ventrículo direito do coração. O Micra só atua na câmara inferior do coração, não podendo ser usado por quem precisa de ajuda na câmara superior.
“Como o primeiro marcapasso sem fio condutor, o Micra oferece uma nova opção para pacientes que consideram um dispositivo marcapasso de câmara única, o que pode ajudar a prevenir problemas associados com os fios condutores,” notou William Maisel, da FDA, em um comunicado.
A FDA disse que ele não deve ser usado por pacientes que já têm um dispositivo implantado, já que pode interferir no funcionamento do marcapasso. Também não pode ser usado por pessoas severamente obesas, ou que são intolerantes a materiais no dispositivo.
