 |
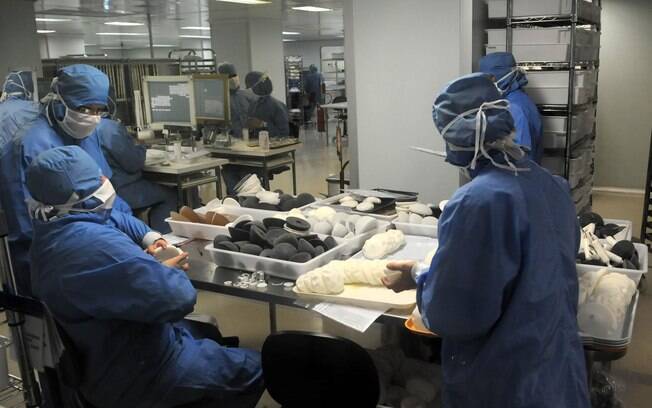
| André Durão - Funcionários da Silimed com os moldes que servirão para as próteses de silicone |
A Vigilância Sanitária da Secretaria de Saúde do Estado do Rio de Janeiro suspendeu a fabricação de todos os produtos da Silimed, a maior fabricante de implantes de silicone da América do Sul, após fiscalização encontrar não-conformidades com relação às Boas Práticas de Fabricação.
A Anvisa também participou da ação e, como medida de precaução, também determinou suspensas a comercialização e o uso dos produtos da empresa. As suspensões, que valem para todo o território nacional, é temporária e durará até que sejam corrigidas as não conformidades identificadas.
Até o momento, não foram identificados riscos à saúde das pessoas que colocaram implantes da marca. Desta forma, a Anvisa informou que não há necessidade da adoção de quaisquer procedimentos para clientes que já convivem com o produto.
Todas as amostras coletadas na inspeção, realizada entre os dias 28 e 30 de setembro, serão enviadas para análise fiscal a fim de avaliar a conformidade dos produtos fabricados.
Procurada pelo iG, a empresa reforçou o caráter preventivo e não comprobatório da supensão e disse que "está tomando todas as medidas necessárias para agilizar o processo e apoiar os órgãos reguladores da Europa e do Brasil, no sentido de corrigir e reverter a situação".
Suspensão também no exterior
A Silimed já teve a suspensão temporária do Certificado de Conformidade Europeu (CE), recomendada pelo organismo certificador da Alemanha, o TÜV Sud. O documento era o que permitia a comercialização de dispositivos médicos da empresa em todo o continente.
A Anvisa disse que mantém contato constante com as autoridades reguladoras estrangeiras com relação ao tema mas que, até o presente momento, também não foi detectado nenhum caso de evento adverso no exterior decorrente do uso dos implantes.
iG



