No último ano, o governo federal acelerou o ritmo das análises feitas para incorporar à rede pública novos remédios e procedimentos.
É o que indica um balanço feito pelo Ministério da Saúde a pedido da Folha sobre o primeiro ano de funcionamento da Conitec, comissão do ministério que avalia os pedidos de incorporação feitos pelo próprio governo, por empresas e entidades.
Em 2012, a comissão analisou 135 pedidos e aprovou 29 tecnologias: entre elas a vacina contra hepatite A.
Outros 61 pedidos de inclusão foram negados e 45 ainda estão em avaliação.
| Ed. de arte/Folhapress | ||
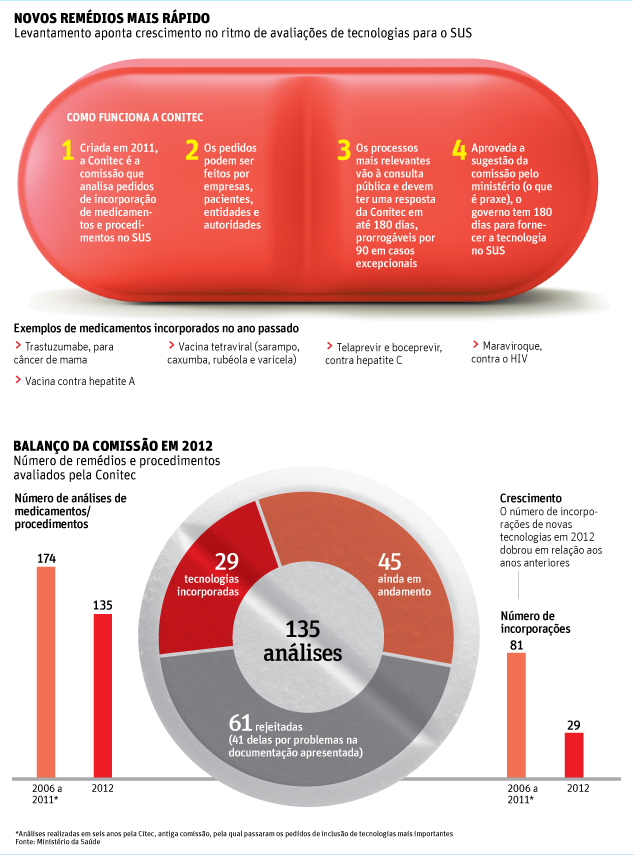 |
Estrutura que antecedeu a Conitec, a Citec avaliou 174 pedidos e incorporou 81 itens entre 2006 e 2011. O levantamento abarca as tecnologias mais relevantes, já que nem toda incorporação tinha que passar pela antiga Citec.
Ou seja, o estudo aponta para um aumento de quase quatro vezes no número de análises feitas em 2012 --conclusão reforçada por estudos feitos pela indústria de medicamentos no país aos quais a reportagem teve acesso.
Para o ministro Alexandre Padilha (Saúde), esse crescimento demonstra que foi correta a ideia de organizar os fluxos e criar prazos para a avaliação. "E não se confirmou a preocupação de alguns usuários de que a Conitec ia retardar a incorporação."
Na prática
Apesar de especialistas e pacientes comemorarem o ritmo mais intenso de avaliações e as novas regras que instituem um tempo máximo para que um pedido seja julgado, há ressalvas à atuação da nova comissão.
A principal crítica é que a comissão rejeita a incorporação de drogas usadas com bons resultados sob a alegação de que não há comprovação científica de eficácia.
Foi o que ocorreu com o trastuzumabe, aceito pela comissão para pacientes com câncer de mama inicial e localmente avançado, mas negado para os casos metastáticos da doença.
O medicamento começou a ser distribuído nesta semana pelo ministério.
Já o pedido de inclusão do remédio everolimo, demandado à Conitec para combater um tumor benigno cerebral que se desenvolve em pacientes com esclerose tuberosa, foi negado. A doença pode causar problemas cognitivos e convulsões.
Sem o everolimo na rede pública, a atriz Bel Kutner brigou por seis meses na Justiça contra o governo até conseguir o medicamento para o filho Davi, de 7 anos.
Há seis meses tomando o remédio, Davi conseguiu uma redução importante no tamanho do tumor, diz Kutner.
"As convulsões estão controladas, ele está se expressando, se desenvolvendo", comemora a atriz, de 42 anos.
O ministro Padilha diz que a comissão se pauta por evidências clínicas e científicas.
"Temos uma série de tecnologias que não têm evidências consolidadas em trabalhos científicos ou experiências de países que adotaram para o sistema público e que, por isso, têm uma decisão inicial pela não incorporação."
O que não impede, continua o ministro, uma reavaliação frente a novos estudos.
Transparência
Para pacientes e médicos, falta transparência às decisões da Conitec, comissão que avalia a incorporação de novas tecnologias à rede pública.
"Gostaria de uma explicação para o que chamam de 'documentação inadequada'. É dado científico insuficiente, é papel mal preenchido?", questionou Rafael Kaliks, diretor científico do Instituto Oncoguia, entidade que apoia pacientes com câncer.
Kaliks afirma que não basta avaliar o funcionamento da comissão em termos quantitativos e que é preciso verificar o que aguarda uma posição ou o que foi rejeitado.
O instituto tem feito críticas à negativa dada ao uso do remédio trastuzumabe para o câncer de mama metastático.
Cláudia Maia, da Sociedade Brasileira de Dermatologia, diz que as decisões da comissão deveriam ser mais discutidas com os especialistas --para além das consultas públicas antes das decisões da Conitec.
Um exemplo são as drogas biológicas pedidas para uso de doentes com psoríase grave --a aprovação foi negada.
"Eles [a comissão] se reuniram sem representantes das especialidades e não levaram em consideração os argumentos da consulta pública."
O ministro Alexandre Padilha nega que haja excesso de burocracia. "A maior demonstração disso é termos analisado quatro vezes mais e incorporado duas vezes
Fonte Folhaonline

Nenhum comentário:
Postar um comentário