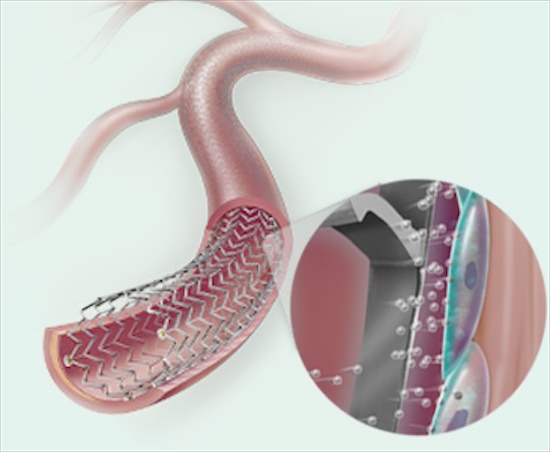
 Dispositivo auto expansível é revestido com a droga paclitaxel, que ajuda a prevenir a recorrência de estreitamento das artérias
Dispositivo auto expansível é revestido com a droga paclitaxel, que ajuda a prevenir a recorrência de estreitamento das artérias
A Food and Drug Administration dos EUA (FDA) aprovou, pela primeira vez, um stent farmacológico indicado para reabrir uma artéria especial na coxa bloqueada devido a doença arterial periférica (PAD).
PAD ocorre quando o material gorduroso, ou placa, se acumula nas artérias que transportam o sangue para a cabeça, órgãos e membros, geralmente afetando as artérias das pernas. Isto provoca o endurecimento ou estreitamento das artérias (aterosclerose), limitando o fluxo de sangue rico em oxigênio para o corpo. Pessoas com PAD podem experimentar sintomas como dor nas pernas, ou complicações graves, incluindo úlceras de pele ou gangrena.
Peripheral Zilver PTX Stent inclui um pequeno tubo de malha metálica chamada stent de metal autoexpansível que mantém a artéria aberta. O stent é revestido na sua superfície externa com a droga paclitaxel, medicamento que ajuda a prevenir a recorrência de estreitamento das artérias.
As opções existentes para o tratamento de PAD incluem exercícios, terapia medicamentosa, e outras opções dentro da artéria, como a angioplastia transluminal percutânea (PTA, ou angioplastia), ou bypass cirúrgico.
"O estudo clínico demonstrou que o Zilver é mais eficaz do que a angioplastia para o tratamento da doença arterial periférica acima do joelho. Esta aprovação expande as opções de tratamento para pacientes que sofrem de doença arterial periférica sintomática", afirma Christy Foreman, da FDA.
A segurança e eficácia do stent foram testadas em ensaios não clínicos extensos, incluindo biocompatibilidade, e testes em animais, bem como um programa de ensaio clínico.
Estudo realizado com 479 pacientes com uma única lesão estenótica inferior mostrou que, após 12 meses, 83% dos pacientes que receberam, aleatoriamente, Zilver PTX Stent, ainda tinham suas artérias abertas, em comparação com 33% no grupo controle.
O dispositivo é contra indicado em pacientes com estenoses que não podem ser dilatadas para permitir a passagem adequada do cateter ou do stent, pacientes que não podem receber tratamento medicamentoso recomendado devido a distúrbios hemorrágicos, ou mulheres que estejam grávidas, amamentando, ou planejando engravidar nos próximos cinco anos.
Como parte da aprovação, a FDA está exigindo do fabricante a realização de um estudo de cinco anos pós-aprovação de 900 pacientes tratados com o Zilver stent para continuar a monitorar a segurança e eficácia do dispositivo.
Fonte isaude.net

Nenhum comentário:
Postar um comentário